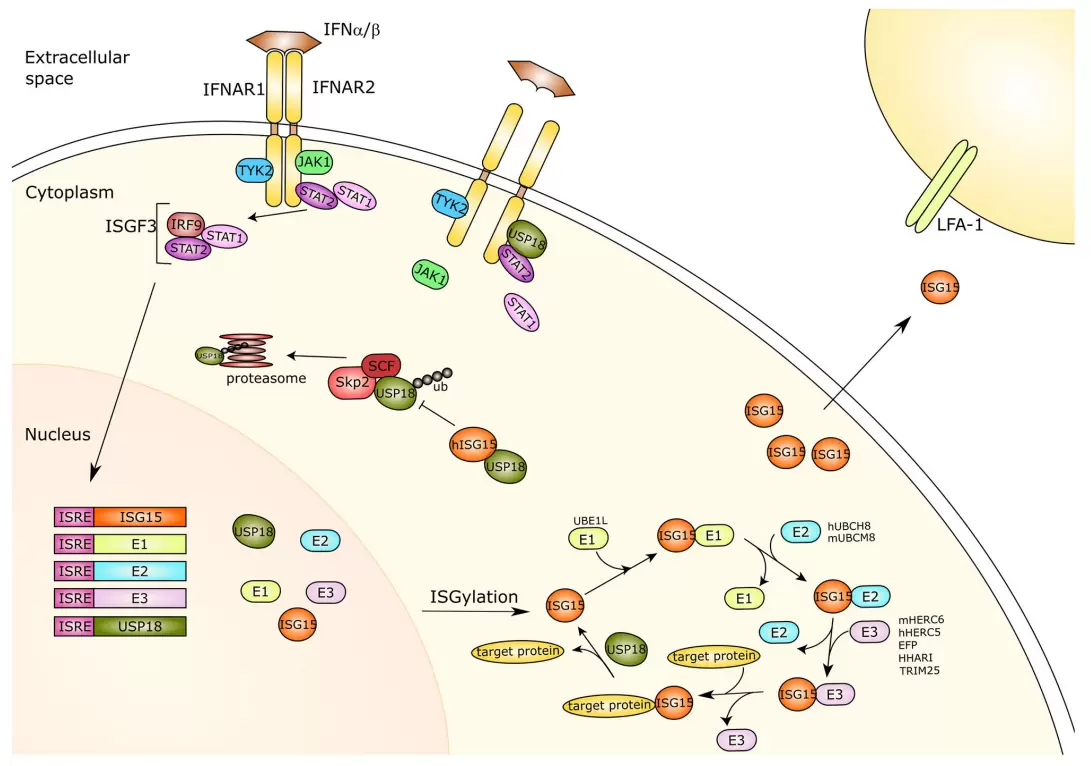
I 型干扰素可强烈诱导ISG15高表达。有趣的是,同SUMO、FAT10以及NEDD8等类似,ISG15被鉴定为泛素样修饰体(Ubl),ISG15可以共价连接到靶蛋白从而改变靶蛋白的各种生物学过程。ISG15由两个 Ubl结构域组成,通过铰链区连接。每个结构域由四个β-折叠加一个α-螺旋形成,与泛素结构高度类似。因此,ISG15的 C 端尾部同样包含LRLRGG 基序,参与靶蛋白结合,即通过LRLRGG 基序共价连接到目标蛋白赖氨酸残基的ε-氨基上。
类似于泛素偶联系统,ISGylation由级联的三步催化介导,该过程所有的酶均由I 型干扰素诱导。E1 活化酶与Ub(或ISG15)结合,并在ATP 的介导下形成复合物,催化Ub(或 ISG15)C端的酰基腺苷酸化。随后,E1酶的催化半胱氨酸与泛素-AMP或 ISG15-AMP复合物相互作用,发生酰基取代,引起硫酯键的形成和AMP的释放。之后,通过硫转移反应,E2的半胱氨酸残基取代E1。 E3-连接酶结合E2-泛素(ISG15)硫酯,并通过E3识别底物从而催化泛素或ISG15 从 E2酶转移到靶蛋白。
与不同物种之间高度保守的泛素不同的是,ISG15在物种之间存在较大差异。目前,ISG15 仅在脊椎动物中得以鉴定,其中,鼠ISG15与人类仅具有 64%的同源性。这一现象可能与机体需快速适应突变的病原体的免疫逃避机制相关。
一型干扰素以及ISG15
到目前为止,已经鉴定了四种ISG15的E3 连接酶。人E3 ISG15-蛋白质连接酶HERC5 (hHERC5) 和鼠对应物E3 ISG15-蛋白质连接酶HERC6 (mHERC6) 是ISGylation 中的主要E3 连接酶,可协调ISG15 与底物的结合。有趣的是,mISG15和 hISG15 都可以与hHERC5 或mHERC6 结合。此外,E3泛素蛋白连接酶雌激素反应性指蛋白(EFP)、果蝇ariadne-1 的人类同源物(HHARI)和TRIM25也被报道可介导ISGylation。
ISGylation发生在新合成蛋白质的共翻译过程中。由于受感染的细胞主要翻译病毒蛋白,ISGylation会干扰病原体蛋白的功能。此外,参与抗病毒防御或病毒颗粒输出的宿主细胞蛋白也发生了ISGylation。目前已经确定了数百种在干扰素刺激后可以被ISG 化的宿主蛋白。这些研究大多表明,ISG15的结合大多影响参与免疫调节的重要信号通路,如IFN、NF-κB以及JNK通路。 其中ISGylation可以通过延长信号蛋白如IRF3、STAT1的激活状态来增强抗病毒信号通路,从而进一步导致I 型 IFN和 ISGs 的表达增加。
ISG15 除了可以发挥ISG 化修饰作用,也可作为一种免疫调节细胞因子分泌至细胞外发挥作用。如ISG15与IL-12 协同作用刺激PBMC释放IFN-γ。随后研究证明ISG15的受体 为LFA-1。
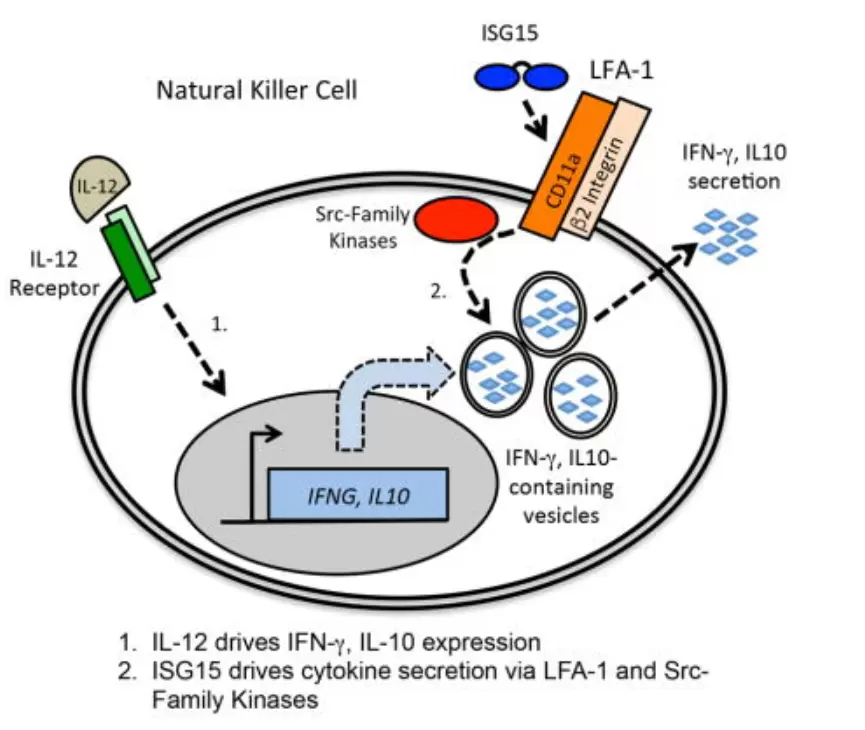
可溶性ISG15通过LFA-1受体参与细胞因子的分泌调控
泛素或Ubl化可以通过一类去泛素化酶(DUB) 作用逆转。这些蛋白酶从目标蛋白中去除Ub/Ubl残基。其中USP2、USP5、USP13、USP14以及USP21可同时去泛素以及去ISG15。但与上述蛋白酶不同,USP18特异性去除ISG15修饰。结构生物学表明,USP18对 ISG15 的特异性由USP18 序列内被称为ISG15 结合盒1 和盒 2(分别为IBB-1 和IBB-2)两个小的相互作用界面所介导。IBB-1 通过与ISG15 的疏水接触相互作用。在ISG15 中,His149的侧链稳定了与Trp121的 π-π 堆积接触。IBB1 区域包含USP18 残基Ala138、Leu142和 His251,形成一个疏水口袋容纳ISG15 的芳香侧链。此外,Pro128(ISG15) 和 Leu142(USP18) 则进一步稳定了这种相互作用。在IBB-2 区域内,USP18残基 Thr262 和Gln259 通过氢键与ISG15 残基Gln114、His116和 Gln119相互作用。此外,结构数据表明,只有ISG15 C 端结构域(氨基酸残基77-155)对于USP18 结合和激活是必要的。体外试验也表明,USP18切割 ISG15 C端结构域与切割全长ISG15 一样有效。
ISG15与USP18相关疾病
在包括小鼠在内的实验研究中,ISG15在宿主对病毒感染的反应中起重要作用。它已被证明可以抵御包括病毒在内的不同类型的病原体所引起的致命性,表明ISG15系统在抗菌宿主防御中的关键作用。然而,临床上ISG15缺失患者并没有表现出更容易受到病毒感染的特质。相反,这类甚至表现出增强的抗病毒保护作用。其中,研究报道三名ISG15 缺陷患者出现癫痫发作以及颅内钙化,即Aicardi-Goutières综合征 (AGS)的常见表型 。在人类,游离ISG15 可结合USP18并防止SKP2 对 USP18的蛋白酶体降解,该过程对于稳定USP18 确保其负调节IFN-α/β至关重要。由于人类USP18 稳定性严重依赖ISG15,这三名ISG15 缺陷患者对I 型 IFN刺激表现出高反应性。但研究人员并未在小鼠中未观察到ISG15 稳定USP18 的功能。另外,近期研究发现USP18缺陷患者预期寿命很短,并且由于I 型 IFN信号的过度活化失调,他们在出生后不久即死亡。5 名诊断为Pseudo-TORCH 综合征(PTS)的患者被证明存在USP18的隐性功能缺失性突变,导致严重的免疫炎症,伴有钙化和多小脑回畸形。该现象使得人们认为USP18可能成为一潜在的治疗靶点,激活USP18抑制 I型 IFN,拮抗USP18或促进USP18 降解可以促进治疗性IFN 的效果。
实验研究同样发现,稳态条件下USP18在维持小胶质细胞处于静息状态发挥了关键作用。USP18 在与IFNAR2 相互作用时负调控STAT1的激活,这种调节功能独立于USP18 催化活性,因为USP18催化失活突变(C61A/C61A)同样也表现出对病毒感染的抵抗力增强,但与USP18−/−小鼠相比,该突变小鼠并没有表现出致命的IFN 超敏反应、脑损伤或更高的死亡率。因此,基于上述分析,选择性抑制USP18 蛋白水解活性将可作为一种潜在的抗病毒策略。
靶向USP18
靶向蛋白降解嵌合体(PROTAC) 或degronimids (泛素标记的小分子,使细胞能够降解小分子结合的蛋白)是将感兴趣的蛋白质募集到特定泛素E3 连接酶的。E3连接酶诱导其泛素化,随后被蛋白酶体降解。这些探针是双功能小分子。该药物发现策略不同于传统意义上的抑制剂。其中ARV-110是第一个被FDA批准用于治疗转移性去势抵抗性前列腺癌患者的口服PROTACs药物。因此,针对USP18 的PROTACS 可能代表了一种潜在的特异性降解USP18从而增强I 型 IFN信号的方法。另外,针对USP18 与重要蛋白质(如STAT2 或ISG15)的相互作用也可能干扰其功能。
原始文献:
JiménezFernández D, Hess S, Knobeloch KP. Strategies to Target ISG15 andUSP18 Toward Therapeutic Applications. Front Chem. 2020 Jan 21;7:923.doi: 10.3389/fchem.2019.00923. PMID: 32039148; PMCID: PMC6985271.


 我的购物车
我的购物车