摘要:虽然肠道Th17细胞对于维持组织稳态至关重要,但它同样也促进了肠外自身免疫性疾病(包括多发性硬化症等)的发生发展。深入了解Th17细胞的潜在机制对防治这类自身免疫性疾病具有重要意义。当地时间12月6日“Cell”在线发表了美国哈佛医学院VijayK. Kuchroo、Aviv Regev等的研究成果。

作者通过将超过84,000个Th17细胞在稳态和神经系统自身免疫性炎症期间的单细胞RNA-seq和TCR-seq克隆分析相结合,在体内表征了Th17细胞的异质性、可塑性和迁移性等特征,揭示了在肠道中存在一种由微生物维持的稳态干细胞样TCF1+/IL-17+/SLAMF6+的Th17亚群体。在诱发脑脊髓炎(EAE)动物模型中,经IL-23刺激该干细胞样Th17细胞分化为致炎性GM-CSF+/IFN-γ+/CXCR6+T细胞。该研究揭示了非致病性的IL-17+细胞如何分化为致病性GM-CSF+/IFN-γ+细胞并诱导肠外自身免疫性疾病的发生。
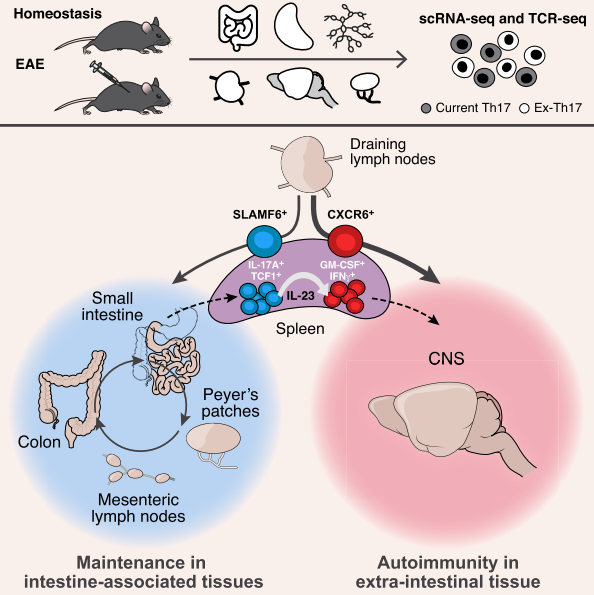
Th17细胞是一类具有白细胞介素-17(IL-17)分泌功能的CD4+T细胞。其中部分亚群能对自身抗原具有特异性识别能力,可诱导组织炎症,因此长期以来Th17细胞被认为参与了多种自身免疫性疾病的发生发展。然而,最近的一系列研究表明,驱动自身免疫组织炎症的并非IL-17或Th17细胞,而是一类具有GM-CSF分泌功能的T细胞(ThGM)亚群。那么Th17细胞与ThGM细胞之间的关系是什么?到底哪种细胞才与自身免疫性疾病密切相关呢?该研究试图解决上述问题。
首先需要了解的是,Th17细胞除了具有高致病性和诱导自身免疫性外,事实上它还参与调节组织稳态和组织完整性。Th17细胞可介导防御细胞外细菌和真菌感染。人体大多数Th17细胞位于肠道中,其对于维持肠道屏障的完整性,限制微生物入侵至关重要。然而有研究证明肠道Th17细胞在某些特异性微生物刺激后可加剧肠外自身免疫性疾病发生发展。组织Th17细胞的稳态是如何被打破,又如何产生致病性,也即Th17细胞介导肠道稳态的同时又促进自身免疫的机制仍不清楚。
近年来研究表明,Th17细胞具有高度异质性,其功能受到环境变化的影响,如昼夜节律、特定代谢物和微生物等。但目前我们并不知道Th17细胞是否也会像FoxP3+Tregs细胞或组织巨噬细胞一样在不同的组织微环境中获得不同的表型和功能。曾有研究暗示,体内Th17细胞同样也具有高度可塑性,能转化成各种不同的效应性T细胞或调节性T细胞亚群。因此需要了解Th17细胞如何在不同的刺激条件下做出响应,使其可维持组织稳态,抑或驱动组织炎症反应。为此,作者基于单细胞RNA测序以及TCR测序(scRNA-seq和TCR-seq),并将其与不同Th17细胞的功能谱及组织分布相结合,对84,124个Th17细胞进行了分析,进而逐一表征其在稳态以及神经炎症方面的异质性、可塑性以及迁移特性特征。作者发现,Th17细胞不仅具有组织特异性,而且也表现出组织内的异质性。通过使用诱发脑脊髓炎(EAE)动物模型,作者在肠道中发现了一种干细胞样TCF1+/SLAMF6+/IL-17+的Th17细胞群体,该群细胞可特异性地分化为一类GM-CSF+/IFN-γ+/CXCR6+的Th17细胞群体,进而迁移到中枢神经系统发挥其高度的致病能力。
这一出色的研究工作详细的阐述了肠干细胞样Th17细胞向致病性Th17细胞的转变过程,完美地解释了学术界关于EAE发展过程中Th17细胞与GM-CSF+/IFN-γ+的致病性的争议。作者猜测该发现可能适用于其他自身免疫性或炎症性疾病。
接下来让我们概括性地回顾一下作者的研究思路及过程。首先为了研究Th17分化过程,作者制备了一种IL17aCreGFPXRosa26tdTomato小鼠。该小鼠在IL-17高表达时(即所谓Current-Th17小鼠)呈现绿色荧光,即IL-17GFP被表达。在IL-17极低表达时(即Th17前体细胞时期),由于早在痕量的Cre酶表达即可切割Rosa26位点的tdTomato前的终止信号而被激活表达,因此tdTomato阳性则代表该细胞为Th17前体细胞和Th17成熟细胞(即Ex-Th17及current-Th17细胞)。
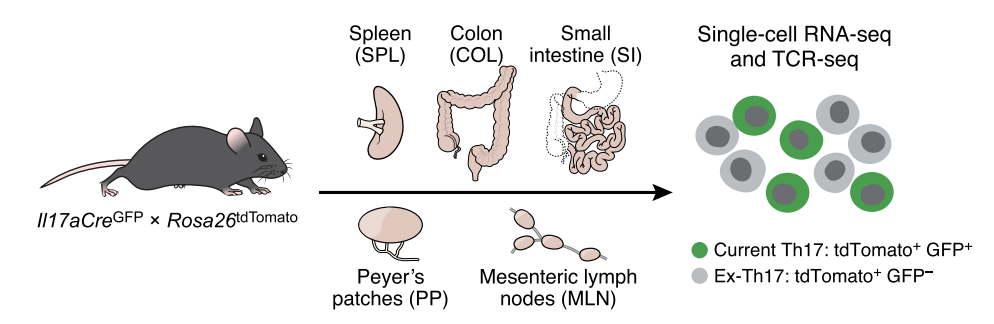
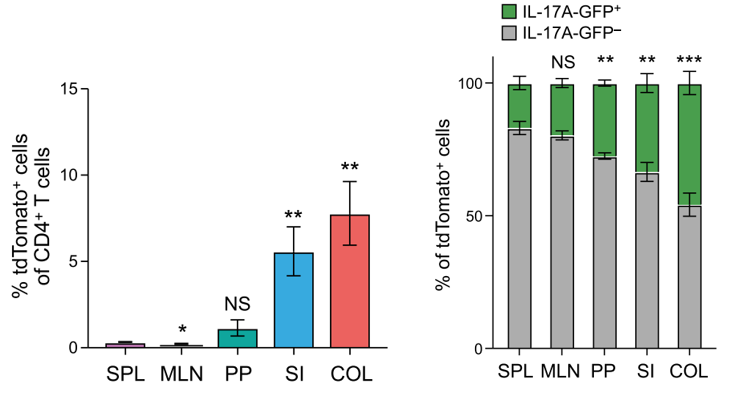
经过提取各脏器分析其中Th17分化情况作者发现,有大量的小肠以及结肠部位的Th17细胞呈现出Ex-Th17细胞表型。
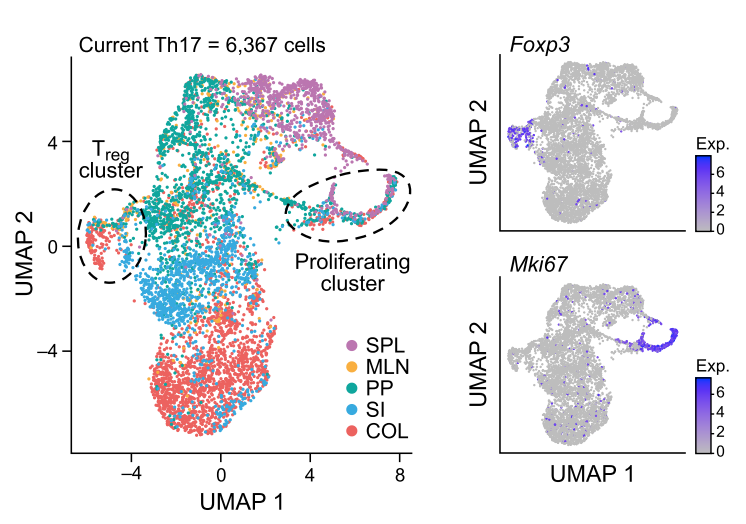
进一步使用聚类分析发现,Th17细胞呈现出明显的组织分布特征。另外也发现存在具有调节性的Foxp3表型以及具有增殖性表型ki67的Th17细胞。
利用脾脏Th17细胞表达量作为参照,发现所有组织Th17细胞均高表达效应性T细胞分子,如Il17a,Il17f, Ifng, Cd69, and Gzmb,低表达抗效应性T细胞分子,如Klf2andIl7r。另外不同组织来源的Th17细胞其具体功能亦呈现差异。如结肠来源的Th17细胞对细菌来源的响应性基因呈现高表达。而在脾脏及外周淋巴组织则高表达干性标记物:Ccr7、Il7r、Sell、Tcf7。肠组织则高表达细胞活化相关标记物:Cd44、Cd69、Il17a、Il17f、Il22、Ifng。
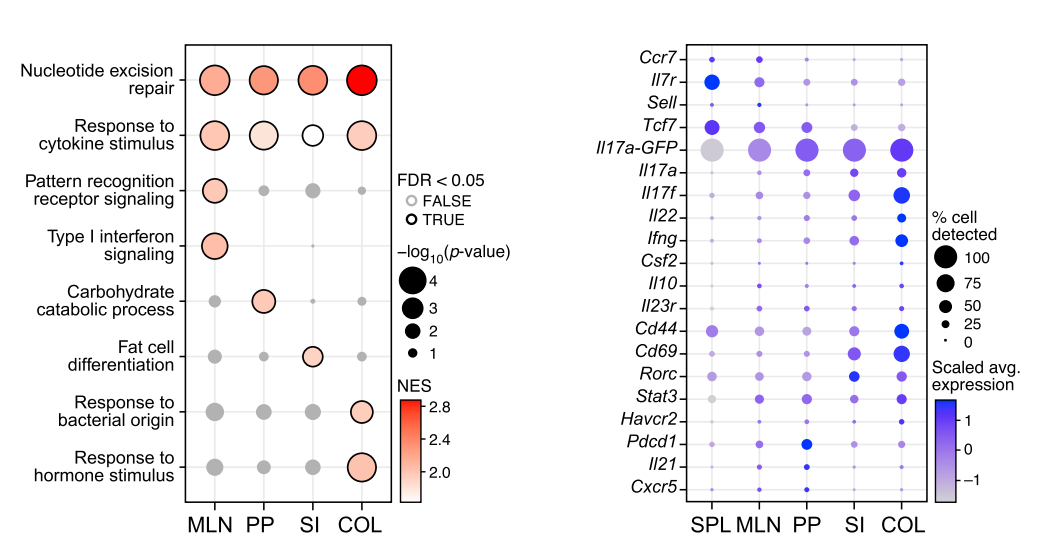
在完成上述研究之后,作者进一步使用MOG35-55多肽免疫动物构建EAE脑膜炎模型,并将模型鼠各组织中的Th17细胞予以提取分析。在小鼠神经系统,作者发现了五类Th17细胞亚群,C0静息型,C1:迁移型,C2:增殖型,C3:CD8样,C4:促炎型。
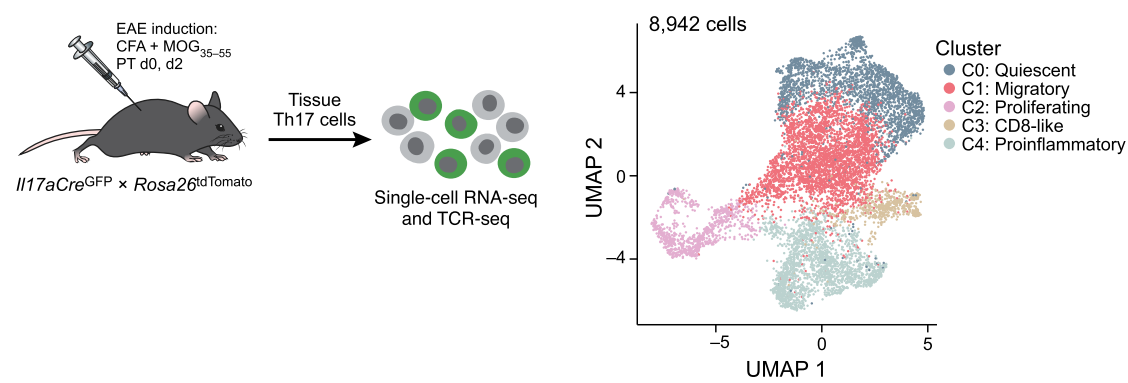
其中CD8样亚群为一类高表达Nkg7、Ccl5以及Cd8a的CD8样Th17细胞,这类细胞同时表达具有细胞毒标记物(Prf1、Gzmk)以及TCRb+/CD4+。作者推测该类Th17亚群与自身免疫密切相关。
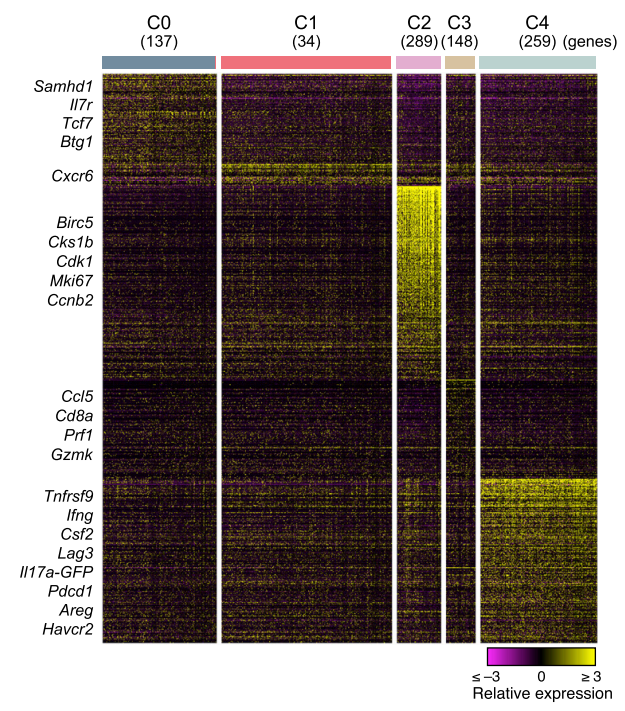
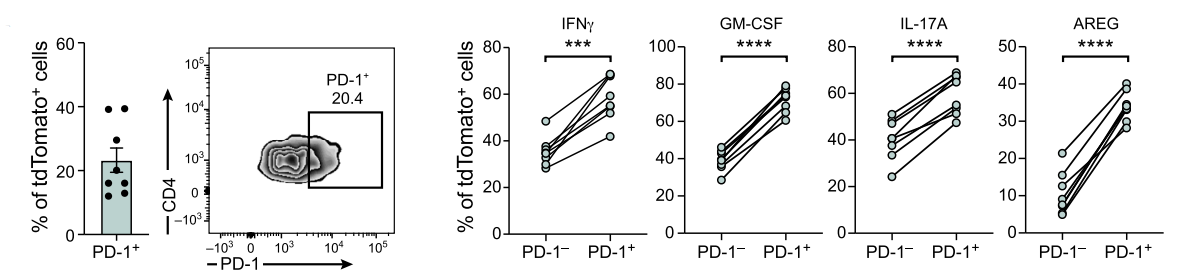
另外对于C4促炎性Th17细胞亚群,作者发现其特异性表达PD-1,且分泌高水平的IL-17A、IFN-以及GM-CSF细胞因子,猜测其可能与诱导神经炎症密切相关。
为了深入探讨EAE模型的发生机制,作者同样分离了各周组织中的Th17细胞,结果发现与疾病前后相比,Th17细胞基因表达特征仍然以组织来源进行分布(如下A图)。进一步分析发现,与其他组织相比EAE可诱导脾脏Th17细胞发生显著改变(如下B-D图)。另外,经TCR测序发现,神经系统Th17细胞与(腹股沟)淋巴结及脾脏呈现高度的相似性,与此同时有10.6%的脾脏Th17细胞与肠道Th17细胞高度相似(E、F图)。基于此作者认为,在自身免疫性疾病发生过程中,脾脏作为一个中心收集来自淋巴结的Th17细胞后,可分别将其输送至肠道及神经系统。
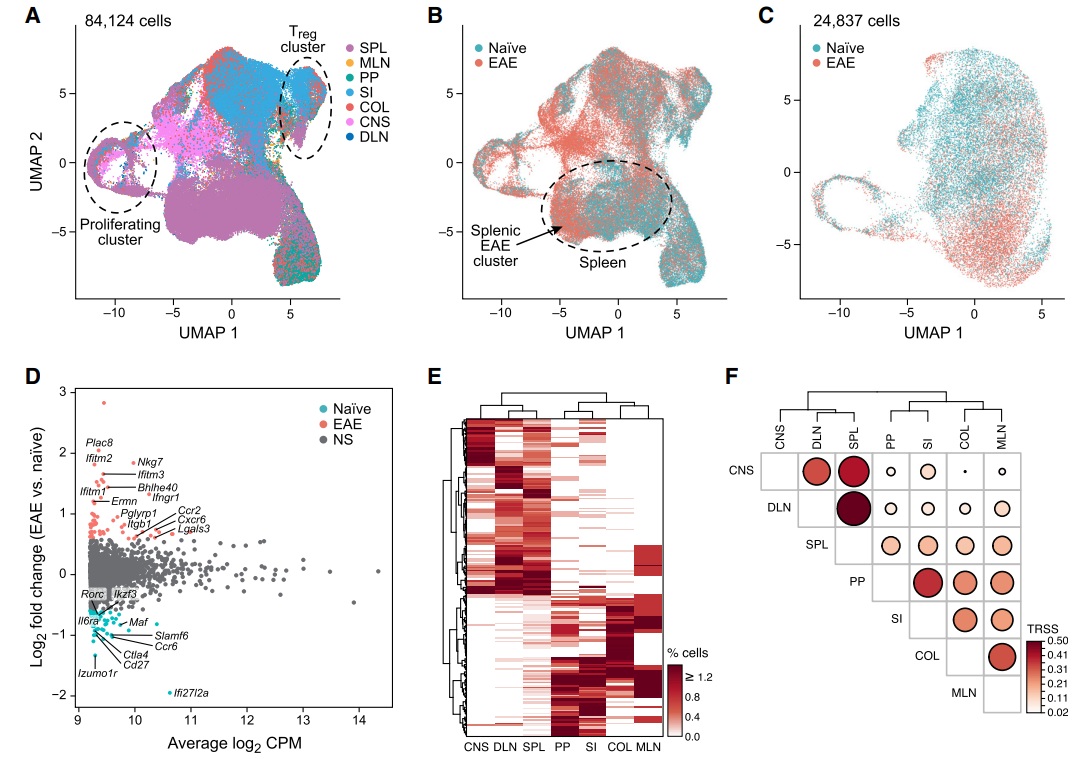
随后作者将注意力集中在脾脏,发现其绝大部分(约85%)的Th17细胞可分为两大类:非致病性SPL0及致病性SPL1(图A-C)。并且与SPL0相比,SPL1发生了显著的克隆增殖过程且高表达Ifng、Tbx21、Bhlhe40、Csf2等(图D-E)。作者进一步发现,SLAMF6及CXCR6可以作为细胞表面标记物用来区分SPL0及SPL1细胞(图F)。与此同时疾病模型可引起脾脏及神经系统SLAMF6+细胞减少而CXCR6+细胞增加(图G-H)。
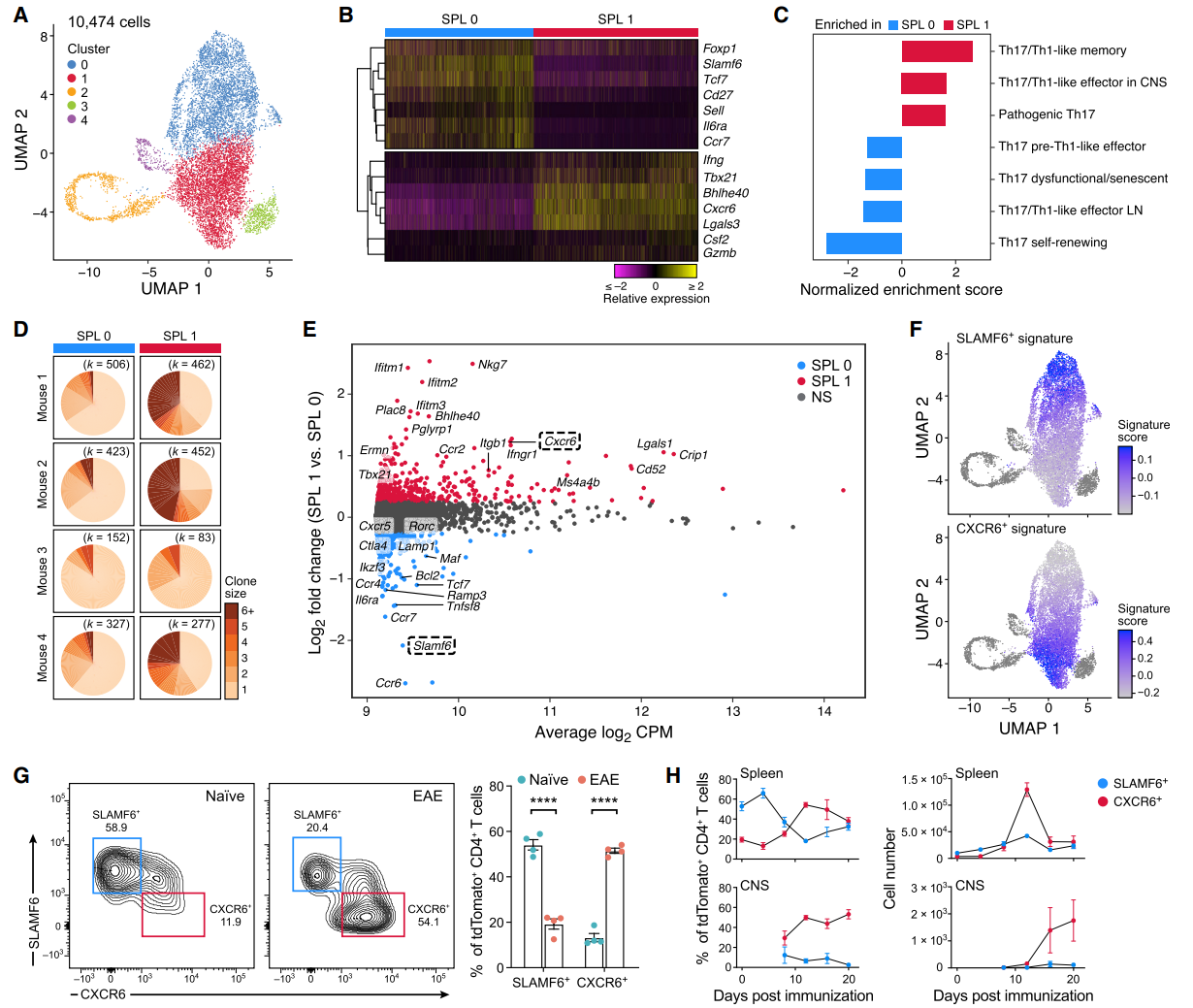
基于TCR表达特征,脾脏SPL0细胞均来自于各组织Th17细胞群,然而SPL1细胞则主要来源于淋巴结及神经系统。另外,SPL0细胞高度表达参与免疫细胞迁移及滞留于淋巴组织(Cxcr5、Ccr7、Sell)和肠道(Ccr9、Itga4)的基因,而SPL1细胞则表达参与免疫细胞向炎症部位转运的基因(Ccr5、Itgb1, Crip1, Cxcr6, Ccr2)。
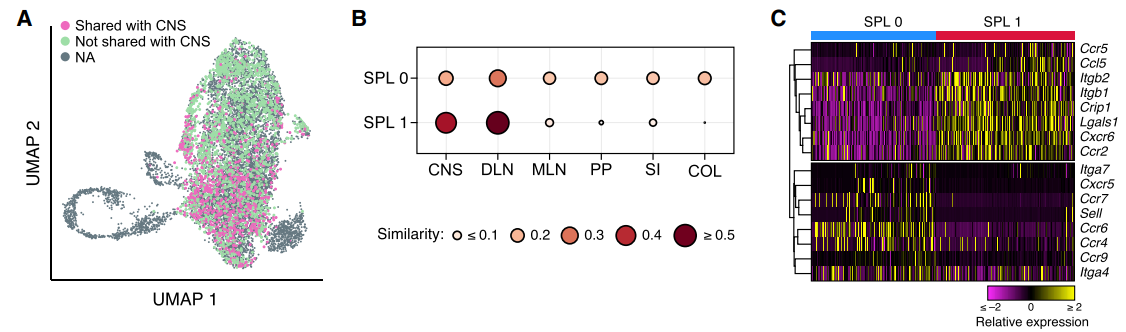
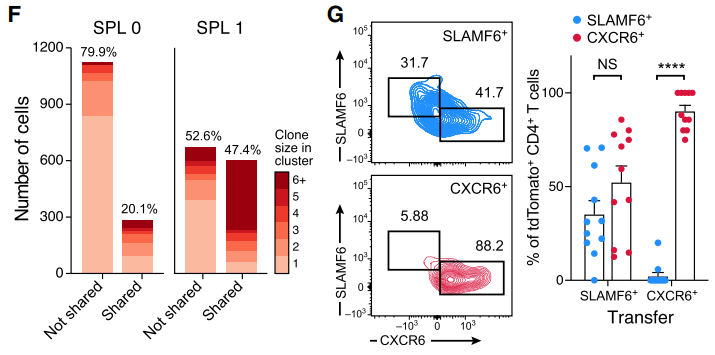
由于肠道Th17细胞被广泛认为参与了EAE发展进程,作者猜测肠道中干细胞样TCF1+/SLAMF6+的SPL0细胞可能在脾脏被持续诱导分化为致病性SPL1细胞。其理由是,首先作者发现20.1%的SPL0以及47.4%的SPL1细胞享有共同的TCR序列。另外SPL0细胞TCR序列异质性更强而SPL1细胞则异质性低但克隆增生能力强(图F)。另外作者将正常小鼠SLAMF6+/tdTomato+的Th17细胞接种至EAE模型小鼠,7天后发现该群细胞获得了CXCR6+特征,即转化为SPL1亚群。然而给EAE小鼠接种CXCR6+Th17细胞则无法在其体内发现SLAMF6+Th17细胞,表明CXCR6+细胞为终末分化细胞类型。
另外,为了证明肠道菌群在EAE发生中的作用,作者使用抗生素清除小鼠肠道菌群,结果发现各脏器中Th17细胞数显著降低,并且脾脏SLAMF6+细胞比例显著低于对照组。与此同时小鼠较难被诱导EAE症状。
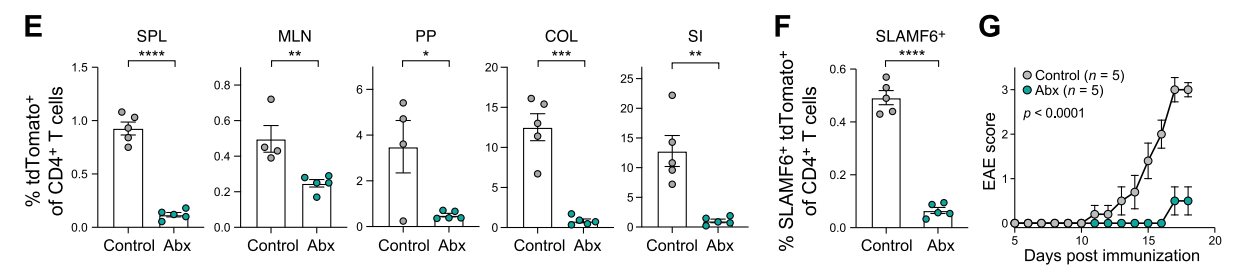
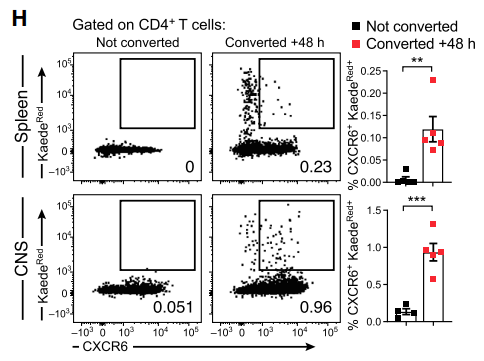
随后为了进一步证明上述过程,作者使用了一种名为Kaede的小鼠,该小鼠表达一种可被紫外线照射而转化为发射红色荧光的Kaede绿色荧光蛋白。作者将模型鼠肠道经紫外线照射后观察发现脾脏及CNS中Th17细胞出现有红色荧光细胞(即肠道来源Th17细胞)。
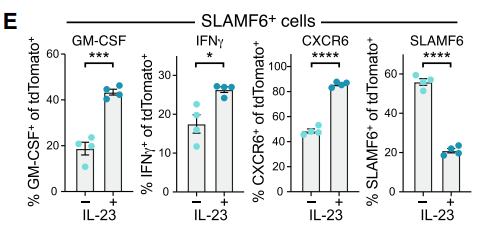
由于IL-23在自身免疫性疾病中发挥了关键作用,作者猜测IL-23可能促进了SPL0向SPL1的分化过程。如图所示,将SLAMF6+细胞与脾细胞共孵育后,IL-23可将SLAMF6+转化为CXCR6+细胞。脾脏中IL-23主要来源于树突状细胞、中性粒细胞、单核细胞及巨噬细胞等。
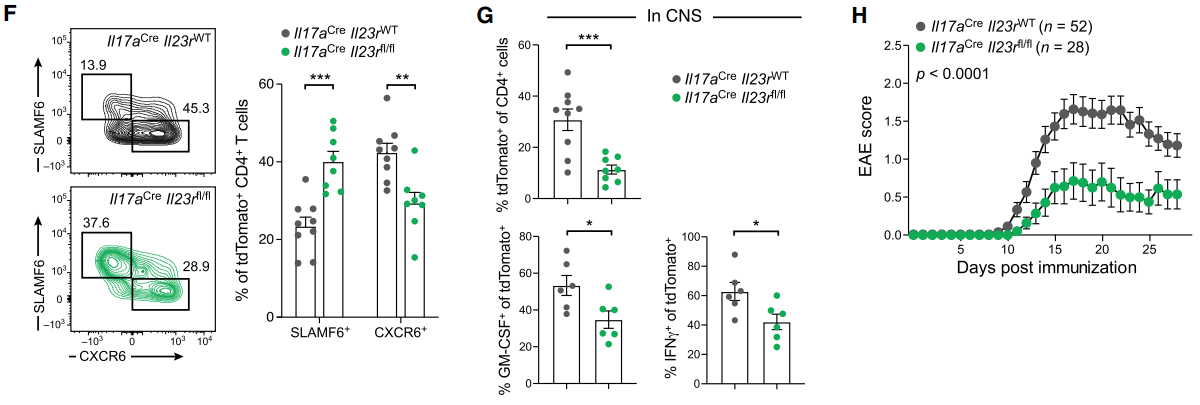
最后为了证明IL-23在Th17细胞中的关键作用,作者制作了Th17细胞特异性的IL-23R敲除小鼠。研究发现,该敲除鼠可显著抑制SPL0细胞转化为SPL1细胞,抑制SPL1细胞在神经系统的聚集,与此同时显著降低了EAE的发生率。
综上,该研究发现了一种潜在的自身免疫性疾病的发生机制,该过程IL-23刺激肠道来源的干细胞样Th17分化为功能性Th17细胞密切相关。因此,干扰该信号传导的任一关键节点可能为更好地控制人类自身免疫疾病发挥靶向调节作用。
参考文献:
Schnell et al., Stem-like intestinal Th17 cells give rise to pathogenic effector T cells during autoimmunity,Cell (2021), https://doi.org/10.1016/j.cell.2021.11.018


 我的购物车
我的购物车