来自美国美国威尔康奈尔医学院以及纪念斯隆-凯特琳癌症中心等多家研究机构的科研工作者11月30日于Nature在线发表其关于1型糖尿病发生机制的最新研究进展。
众所周知,1型糖尿病(T1D),是一种自身免疫性疾病,尽管其直接的发病机制为胰腺中的胰岛β细胞无法有效释放胰岛素,从而导致身体组织无法正常利用葡萄糖的同时血糖升高,引起一系列严重的并发症。
在机制研究中,通常使用非肥胖糖尿病小鼠(NOD小鼠)作为T1D的临床相关模型,其与人类疾病有许多共同特征。包括对许多与人类相同的β细胞抗原的自身CD4和CD8T细胞反应。其中识别β细胞IGRP(胰岛特异性葡萄糖6-磷酸酶催化亚基相关蛋白)的CD8 T细胞是人类和小鼠共通的主要致病T细胞群体。已有研究表明,NOD小鼠中的β细胞特异性CD8T细胞必须在浸润胰腺组织之前在胰腺引流淋巴结(pLN) 中启动致敏过程。为此,作者将研究重点聚焦于pLN中IGRP特异性CD8T细胞。作者发现该类T细胞早在小鼠出生后第5即可检出,15-20周可达总CD8T细胞的0.3-20%。这类T细胞高表达CD44,为激活的效应T细胞。与此同时作者研究发现,尽管其高表达PD1、CD38、CD39、LAG3以及TIGIT等免疫抑制性标志物,这类T细胞具有高度免疫杀伤活性且高表达IFNγ以及TNFα潜能。作者基于TCF1表达情况及转录组数据发现存在三种T细胞亚群:
1、pLN TCF1hi T细胞亚群:高表达Wnt靶基因(Myc、Prickle1和Axin2),具有自我更新及干性特征;
2、pLN TCF1lo T细胞亚群:高表达细胞分化及效应性标志物(Prdm1、Id2、Fasl、Ifng、Entpd1、Cd38、Tigit、Cish);
3、胰岛TCF1lo T细胞亚群:较pLN TCF1lo T细胞亚群更进一步分化,表达更高水平的Id2、Lag3、Entpd1、Gzmb、Pdcd1以及Ifng。
作者发现NOD来源的自身免疫性IGRPCD8 T细胞与基于外源性感染IGRP蛋白产生的T细胞具有完全不同的表面标志物。使用T细胞移植进一步证明,仅pLNTCF1hi T细胞可引起NODScid小鼠产生1型糖尿病症状,且在小鼠体内可同时检测出pLNTCF1lo T细胞亚群以及胰岛TCF1loT细胞亚群,进一步证明了pLNTCF1hi T细胞具有自我更新能力。
总之,该研究证明,pLNTCF1hi细胞代表了一群干细胞样自身免疫祖细胞(autoimmuneprogenitor,AP),其具有长期自我更新且逐步分化为破坏β细胞的终末分化的胰腺TCF1lo自身免疫介导物(autoimmunemediator,AM)细胞。AP细胞为产生和补充胰腺AM细胞池所必需,而作为终末分化细胞AM池是短暂的,无法独立维持导致1型糖尿病的长期的β细胞破坏作用。基于此,作者提出一下观点:致糖尿病T细胞反应的诱导和维持需要两个功能不同的群体:短寿命的具有破坏β细胞的胰腺AM细胞以及具有自我更新能力的pLNAP细胞。二者相互协调最终达到持续的β细胞损伤,引起1型糖尿病。此外,作者的研究结果亦解决了困扰学术界多年的悖论,即为何长期的β细胞的抗原暴露为何无法像肿瘤或慢性病毒感染那样导致机体产生免疫耐受?其原因是胰腺AM是分化的短寿命T细胞亚群并非受到慢性抗原刺激分化而来,而是来自于pLNAP的持续不断补充(如下图所示)。
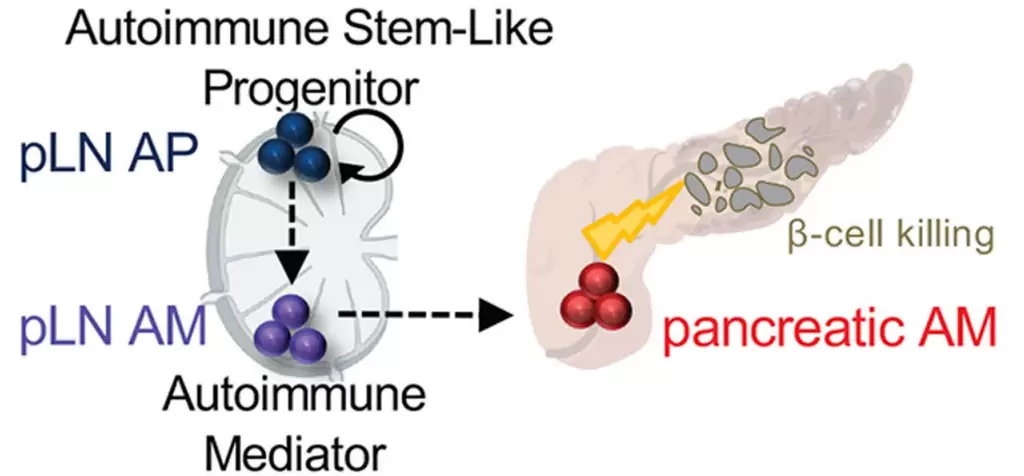
上述研究给1型糖尿病提供了一种崭新的治疗途径:靶向干性AP细胞以消除致病性AM的来源。 例如,FDA批准的治疗多发性硬化症的FTY720(芬戈莫德,该化合物可在胞内被磷酸化为一种S1P激动剂,抑制T细胞从次级淋巴管流出)可能是1型糖尿病患者的有效治疗策略。另外,抗CD3治疗(Teplizumab)已被证明可长期保护1型糖尿病高危患者,其潜在机制可能与AP细胞耗竭相关。
综上,该研究工作揭示了干细胞样CD8T细胞如何启动与维持靶向β细胞损上,最终诱导1型糖尿病的发生发展。靶向该机制极有可能成为1型糖尿病的新型的免疫治疗措施。
参考文献:
Gearty, S.V., Dündar, F., Zumbo, P. et al. An autoimmune stem-like CD8 T cell population drives type 1 diabetes. Nature (2021). https://doi.org/10.1038/s41586-021-04248-x


 我的购物车
我的购物车