T卵泡辅助细胞(follicular helper,Tfh细胞)是CD4+ T细胞的一个特殊亚群,它位于次级淋巴组织(包括扁桃体、脾脏和淋巴结等)的B细胞滤泡中,可提供相关的B–T细胞相互作用和细胞因子,从而促进生发中心(GC)的形成以及B细胞分化为记忆B细胞或浆细胞,驱动其免疫球蛋白的类别转换,产生并维持体内长时间及高亲和力抗体。基于此,Tfh细胞对免疫系统的建立以及功能的完善极为关键,特别是针对细菌病毒等感染性疾病的体液免疫起决定性调节作用。具体来说,CD4+ Tfh细胞通过识别与B细胞相同的抗原来支持B细胞的增殖分化。在该过程中IL-21发挥了关键的作用。IL-21已被证实可促进干性/记忆性CD8+ T细胞(stem-like/memory CD8+ T cells)的T细胞生长因子。事实上有研究认为,CD4+ T细胞对记忆性CD8+ T细胞形成的辅助作用极有可能是通过Tfh细胞来介导的。
值得注意的是,目前在肿瘤免疫治疗中(如肾癌和转移性黑色素瘤)应用IL-2刺激T和NK细胞活化,但遗憾的是IL-2是Tfh分化最强的抑制剂。有研究证实,用IL-21培养扩增的肿瘤特异性T细胞进行肿瘤过继治疗,治疗效果显著优于用IL-2培养的终末分化的T细胞,表明IL-21可能是较IL-2更有价值的肿瘤免疫治疗药物研发靶点。
在肿瘤领域,近年来的研究证实,在一系列癌症疾病中,B细胞和Tfh细胞的存在与患者生存期延长以及良性预后密切相关,尤其是当Tfh位于肿瘤相关三级淋巴组织(tumor-associated tertiary lymphoid structures,TLSs),这种相关性更加密切。例如,2020年三篇Nature文章与一篇Cell文章均报道了在大型临床队列研究样本及小鼠模型中,B细胞浸润及其相关T细胞免疫应答对抗肿瘤免疫所起的重要作用。但是,对于这一临床现象的生物学机制,如TLSs中Tfh细胞是否具有肿瘤抗原特异性以及其与B细胞相互作用是否为抗肿瘤免疫反应中的重要一个环节,目前的认识还十分有限。因此,探讨肿瘤微环境中肿瘤抗原特异性B细胞及T细胞分化及其相互作用机制成为领域内的研究热点。
当地时间11月30日在线发表的Cell文章中,来自耶鲁大学Joseph Craft及Nikhil Joshi课题组的Can Cui等利用KRAS/p53双突变肺癌小鼠细胞模型,研究了不同类型肿瘤抗原对于CD4+ T细胞分化的特殊作用,深入探讨了B细胞和CD4+ Tfh细胞相互作用对于产生细胞因子IL-21及诱导有效肿瘤免疫应答的意义,并验证了十余年来多篇文章所报道的CD4+ T细胞来源的IL-21对于效应性CD8+ T 细胞功能的关键作用。
作者首先强调,临床研究发现仅有20%的肺细胞腺癌(Lung Adenocarcinoma,LUAD)对免疫检查点抑制剂敏感。为了解决这一问题,需要进一步细致了解不同类型的肿瘤浸润T细胞如何与其他免疫细胞相互作用从而调控抗肿瘤免疫。近年来,人们逐渐发现CD4+辅助性T细胞以及B细胞在肿瘤癌症免疫中的重要作用。其中Th1、Th2、Th17等研究较为深入,而对Tfh细胞则研究极少。
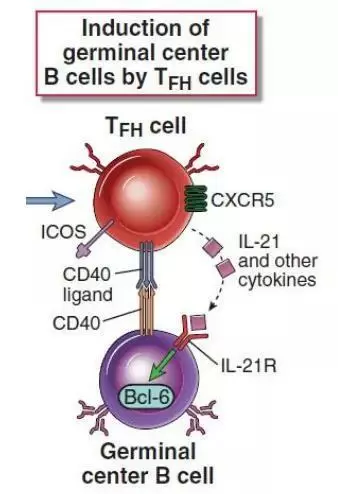
在典型的T细胞依赖性免疫反应中,Tfh细胞分化成熟需要与两种抗原呈递细胞相互作用:1)树突状细胞 (DC)通过提供抗原-MHC II 类复合物与共刺激(包括由通过DC上的ICOS配体 (ICOSL) 诱导ICOS激活)。这些信号与一系列细胞因子共同作用启动Tfh转录因子Bcl-6以及Ascl2,导致PSGL1下调以及PD1及CXCR5上调,获得Tfh前体细胞表型(CD44hi PSGL1lo)。随后,前体Tfh细胞进一步与携带有ICOSL以及相同抗原MHC II分子的B细胞相互作用诱导Tfh细胞通过其表面的CXCR5受体迁移至生发中心成熟为功能性Tfh细胞。成熟的Tfh细胞(CD44hi ICOShi PSGL1lo PD1hi CXCR5hi)可通过其CD40配体(CD40L)以及IL-21诱导位于生发中心的CD40+ B细胞分化和成熟为记忆性B细胞和长寿浆细胞。因此,由共同抗原参与的双向Tfh细胞-B细胞相互作用在启动维持强有力的体液免疫发挥了关键作用。然而,肿瘤特异性Tfh和B细胞之间相互作用的重要性目前尚未得到证实。
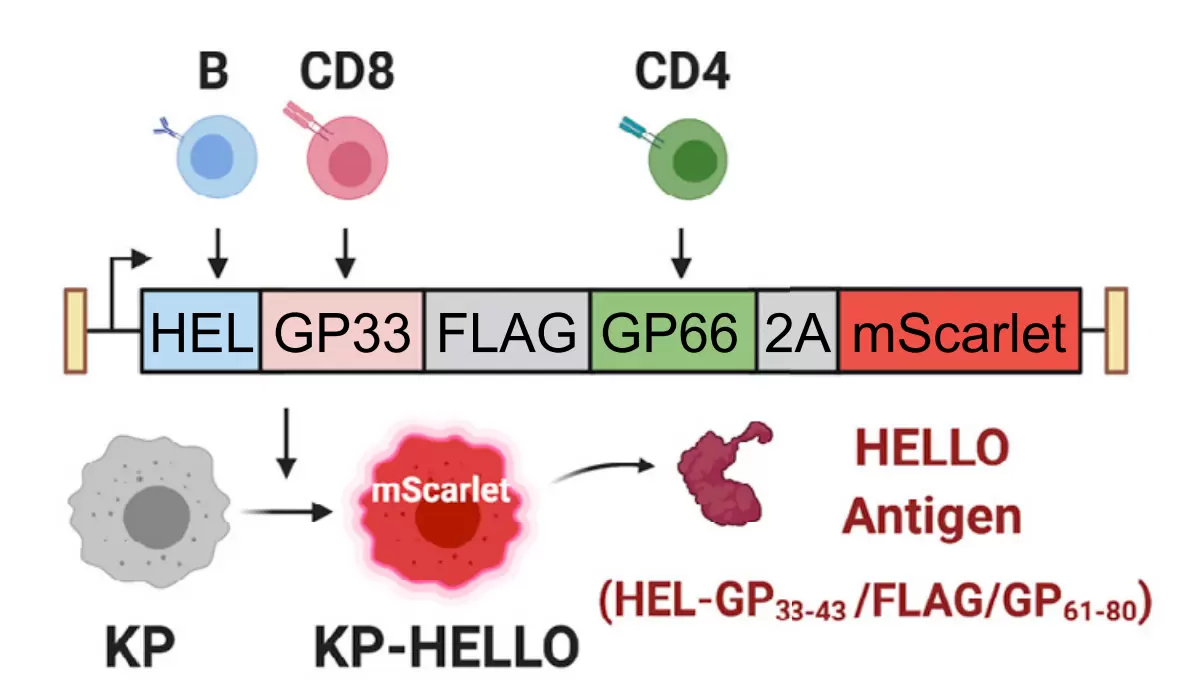
早期研究发现,对于抗病毒感染及肿瘤以至于免疫检查点抑制剂,CD4+ T细胞深度参与并维持了CD8+ T细胞的细胞杀伤功能,但其具体机制并不清楚。有研究认为CD4+ T细胞可表达分泌IL-21从而维持CD8+ T细胞功能,抑制其进入耗竭状态。尽管IL-21可表达于NKT细胞以及Th17细胞,一般认为IL-21为Tfh细胞的重要特征。为此,作者通过研究分析癌症基因组图谱数据库(TCGA)和单细胞 RNA 测序数据,发现Tfh细胞与GC B细胞和LUAD患者的存活率演唱密切相关。由于KP(即KrasLSL-G12D; Trp53fl/fl)模型细胞系的突变率极少,无法激起有效的T细胞及B细胞反应。为了进一步研究Tfh-B细胞的相互作用在抗肿瘤反应中扮演的角色作用,作者在此基础上制备了一种名为KP-HELLO的小鼠肺腺癌模型。在该模型中KP肿瘤细胞表达B细胞和T细胞均能识别的新抗原(HEL,LCMV GP33–43/FLAG/GP61–80和密码子优化的mScarlet),结构如下图所示。
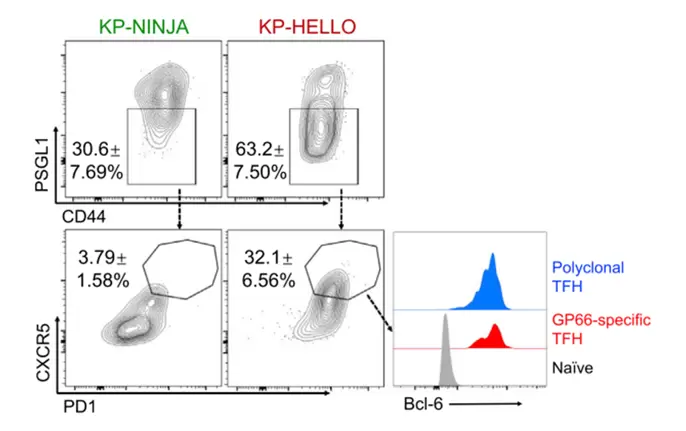
与对照组(KP-NINJA)相比,KP-HELLO肿瘤细胞能激活Tfh细胞分化,如下图所示。
进一步,作者发现,与T细胞及B细胞类似,小鼠肿瘤特异性Tfh细胞和GC B细胞反应为抗肿瘤免疫所必需。
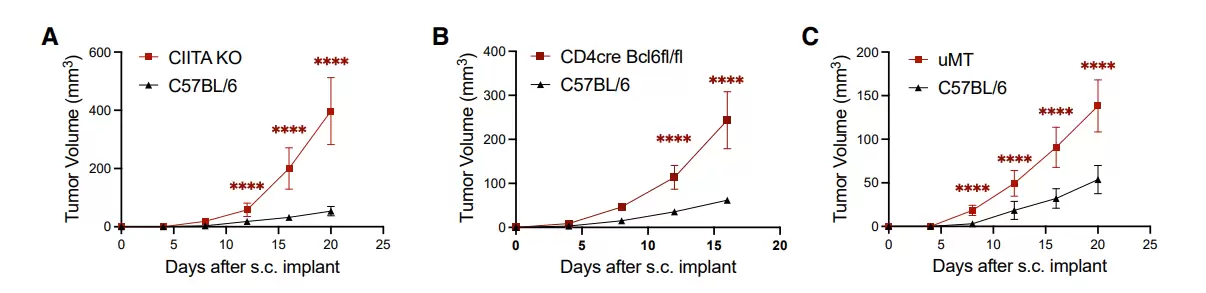
作者进一步证明,在没有T细胞-B细胞相互作用或敲除IL-21受体的情况下则无法抑制肿瘤生长。 IL-21 主要由 Tfh 细胞产生,其发育需要B细胞。此外,肿瘤特异性Tfh细胞反应也依赖于表达B细胞识别neoantigen的肿瘤,表明肿瘤特异性neoantigen可以通过促进其识别的B细胞与肿瘤特异性CD4+ T细胞的的相互作用来控制该T细胞的命运。
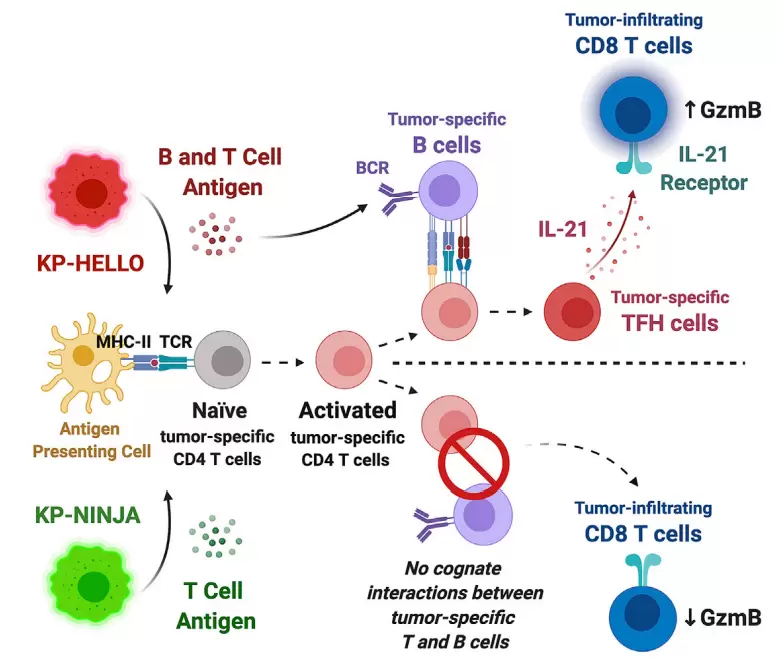
总之,作者呈现的数据强调了B细胞-Tfh细胞协同作用并通过IL-21驱动抗肿瘤CD8+ T 细胞抗肿瘤反应的重要机制。该研究指向了一种新的免疫疗法:靶向B细胞-Tfh细胞-IL-21信号轴增强抗肿瘤特异性免疫,进而提高对肺癌和其他敏感癌症患者治疗效果。
参考文献:
Cui et al., Neoantigen-driven B cell and CD4 T follicular helper cell collaboration promotes anti-tumor CD8T cell responses, Cell (2021), https://doi.org/10.1016/j.cell.2021.11.007


 我的购物车
我的购物车