今日,FDA宣布批准SAGETherapeutics公司开发的Zulresso(brexanolone)上市,用于治疗产后抑郁症(postpartumdepression, PPD)患者。这一疗法将在经过风险评估和缓解策略认证(REMS)的医疗机构中由合格的医护人员注射。Zulresso是SAGE公司第一款获得FDA批准的疗法。
Brexanolone是一种可溶性的合成别孕烷醇酮(allopregnanolone)的静脉制剂,是一种GABAA受体的别构调节剂,它可以调节神经突触内和突触外GABAA受体的功能。对神经递质受体的别构调节能够将受体活性调节到不同水平,而不是完全激活或者抑制受体。
Zulresso(brexanolone)别孕烷醇酮
临床研究发现,血液中别孕烷醇酮每增加1ng/mL,发生PPD的风险降低至63%。而在怀孕期间没有抑郁症的小组时,则该现象消失。
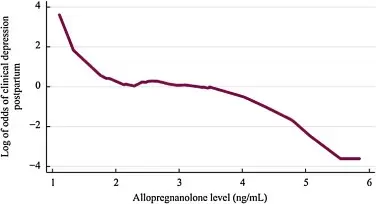
别孕烷醇酮水平与临床PPD发生率
GABAA受体和NMDA受体分别起到抑制和刺激大脑神经元产生神经冲动的作用。这两种受体活性之间的失衡是导致抑郁症等多种精神疾病的原因。Zulresso能够有效和安全地恢复GABAA受体和NMDA受体活性之间的平衡。Zulresso曾经获得FDA授予的突破性疗法认定和EMA授予的PRIME药品认定。
这一批准是基于名为Hummingbird的临床试验项目,它包括3个多中心,随机双盲,含安慰剂对照的临床试验。在名为Study202B和Study202C的两项3期临床试验中,Zulresso达到了两项试验的主要终点,在接受治疗60小时之后,患者汉密尔顿抑郁量表(HAM-D)评分与基线相比的下降幅度显著优于安慰剂组。接受Zulresso治疗的患者HAM-D总分平均下降14-20点,并且可以维持长达30天。
波士顿布莱根妇女医院的精神科医生MarcelaAlmeida博士说:“目前的抗抑郁药物需要数周才能见效,而接受Zulresso治疗的妇女在三天内就可以获得显著改善。这对于她们来说非常重要,因为这是新晋母亲与她的孩子创建关系的关键时期。”
SAGE公司致力于使用别构调节剂来治疗不同类型的中枢神经系统疾病。除了这款获批的Zulresso以外,该公司的药物研发管线中还有治疗重度抑郁症(MDD)的SAGE-217。去年,SAGE与日本盐野义制药公司达成协议,将在亚洲地区共同研发和推广SAGE-217。目前这款口服在研新药已经进入3期临床试验,而且近日在治疗PPD的3期临床试验中也获得积极结果。
我们祝愿Zulresso能够早日为新晋母亲们消除PPD带来的困扰,也期待SAGE的其它抗抑郁新药取得新的研发进展,早日为全世界,尤其是亚洲的抑郁症患者带来创新疗法。
参考资料:
[1] SageTherapeutics Announces FDA Advisory Committee Votes 17-1 in Supportof Benefit-Risk Profile of ZULRESSO™ (brexanolone) Injection forTreatment of Postpartum Depression. Retrieved March 16, 2019
[2] SageTherapeutics Submits New Drug Application to U.S. FDA for IntravenousBrexanolone in the Treatment of Postpartum Depression. RetrievedMarch 18, 2019
[3] FDAapproves first new drug developed for women with postpartumdepression. Retrieved March 19, 2019
[4] LaurenM. Osborne, Fiona Gispen, Abanti Sanyal, Gayane Yenokyan, SamanthaMeilman, Jennifer L. Payne,Lower allopregnanolone during pregnancypredicts postpartum depression: An exploratorystudy,Psychoneuroendocrinology,Volume 79,2017,Pages 116-121,ISSN0306-4530


 我的购物车
我的购物车