摘要:西地那非是一种FDA 批准的治疗勃起功能障碍(伟哥)和肺动脉高压的药物,当地时间12月6日发表于“Nature Aging”的文章显示,该药可能成为预防和治疗阿尔茨海默病的有效候选药物。
阿尔兹海默症(AD)是神经退行性疾病中最为普遍的失智症(dementia)形式,预计到2050 年美国将有1600万人患有AD。这种疾病有两个突出的病理学特征:首先是患者神经元中大量的淀粉样蛋白β (Aβ)聚集及斑块的形成,另外伴随着tau蛋白的过度磷酸化所引起的神经原纤维缠结。一般认为Aβ蛋白的聚集会引发一系列致病过程,例如炎症和突触功能障碍,并导致tau缠结的形成。有关Aβ的积累以及tau蛋白病理学改变的假说已经主导了该领域超过25年之久。然而,抗tau蛋白或抗淀粉样蛋白的选择性药物对AD患者仍缺乏临床有效性。另外,AD的易感性极为复杂、是基因与环境共通作用的结果。因此,从细胞和分子相互作用组学的角度探讨其如何被扰动导致疾病倾向性将对理解AD发生发展及开发治疗策略至关重要。在此,作者认为该过程必须包括对内表型(endophenotype)的分析,内表型是反映离散生物系统功能的中间遗传特征,与外表型相比具有较好的稳定性。淀粉样蛋白和tau蛋白的病理学变化则是AD重要的内表型之一,可能为多组学及多数据库筛选生成预测模型提供基础,以表征AD的发病机制和治疗发展。
作者进一步推测认为,药物靶点分子不可能在体内复杂蛋白质系统中独立运行,也正因为如此,必须在适当的综合环境中检查每个药物-靶点相互作用,从而发现一些已批准药物潜在的新的疗效。

在本研究中,作者建立了一套基于多数据中心的先进的网络系统用于辨别产生AD内表型一系列关键节点分子,然后利用这些节点去筛选分析能最大程度的干扰相关节点的FDA候选药物。
该研究基于以下几个推理:(1)遗传学上关联密切的靶点可使临床开发成功率翻倍,(2)与疾病表型密切相关且在功能上能够控制疾病表型的节点蛋白质通常已存在于人类蛋白相互作用(PPI)网络的相应疾病模块中,(3)由于PPI可能存在共同功能靶点和途径,使其可能成为多种疾病共同的药物靶点。
基于上述推理,作者囊括了三种疾病基因:(1)种子基因(经多种实验验证的AD基因),(2)来自七种类型的具有淀粉样蛋白或tau蛋白病理特征的转基因小鼠模型转录组学的差异表达基因(DEG),(3)从三种AD转基因小鼠模型产生的蛋白质组学数据。在此基础上,功能富集分析发现,AD种子基因在与AD淀粉样变性或tau蛋白病相关的所有13个基因数据库中均被显著富集。在144个AD种子基因中,有102个被证明通过人类PPi连接以形成子网络。随后作者使用网络邻近方法筛查了药物靶点和疾病模块之间的网络关系。其中包括ClinicalTrials.gov数据库及文献中收集的AD临床试验的21种现有药物并将这些药物分为三类作用机制:(1)抗淀粉样蛋白,(2)抗tau蛋白;(3)双重靶向淀粉样蛋白和tau蛋白。随后作者利用网络邻近法来量化AD内表型疾病模块与人类PPi网络中药物靶标之间的关系。作者发现,与单独靶向淀粉样蛋白或tau蛋白药物相比,同时靶向淀粉样蛋白和tau蛋白的药物与AD疾病模块的网络接近度要小得多。同时,这些网络观察支持基于内表型模块的药物发现概念。为此作者通过利用淀粉样蛋白和tau蛋白的双重内表型模块开展了已知药物的AD再利用研究(流程如下图所示)。具体包括:(1)AD内表型模块的构建和验证,(2)通过网络邻近分析开展计算机药物再利用,(3)基于人群的验证以测试药物使用者的AD发病情况,(4)采自AD患者iPSC的人小胶质细胞和神经元的基于网络的体外机制观察。
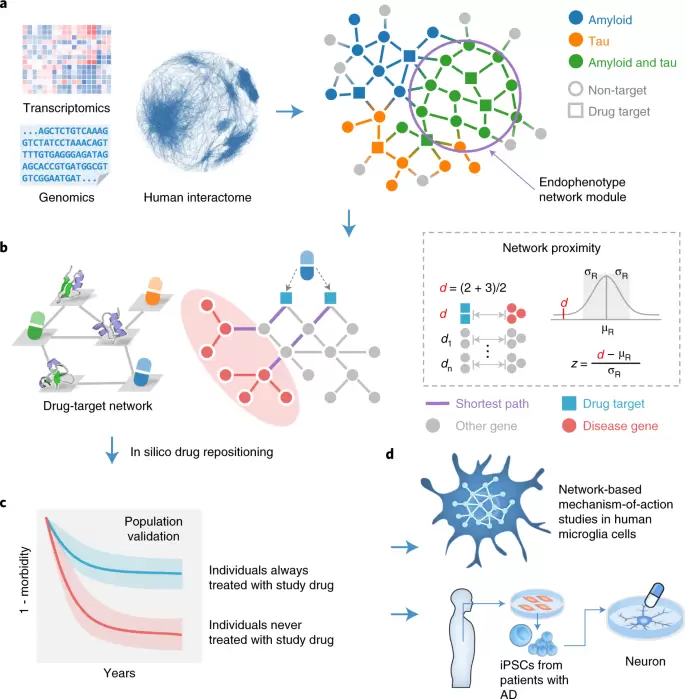
a,人类蛋白-蛋白相互作用网络中AD内表型疾病模块的构建和验证。b,基于网络邻近分析的药物再开发。c,临床调查验证以测试候选药物能否防治AD。d,基于网络的AD患者小胶质细胞或者iPSC来源的神经元细胞中对相关靶点的机制验证。
作者总共汇编了1,608种FDA批准的药物。另外作者通过计算Z分数用以量化PPi网络内药物靶标和网络其他蛋白质之间的网络接近程度(最短路径长度)并根据AD种子模块的网络接近度筛选所有FDA批准的药物,随后选择Z分数最低的前100个候选药物。进一步,作者计算了该100个候选药物与其他12个AD模块的网络接近度。
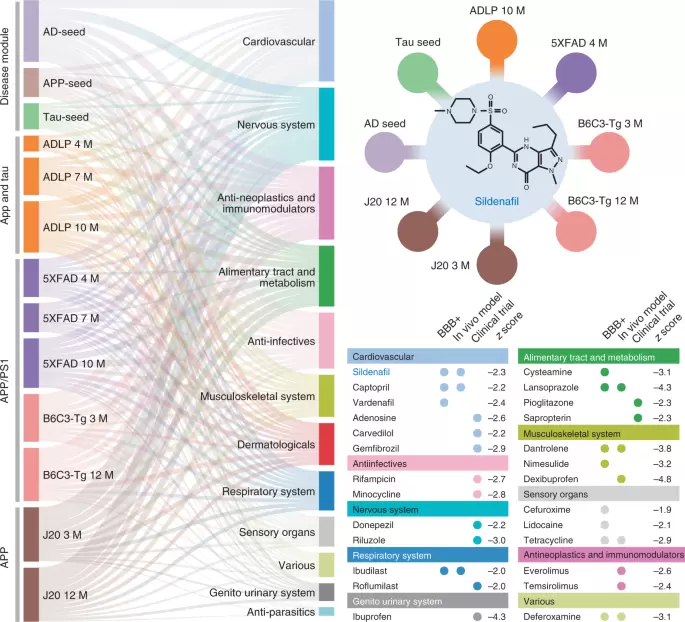
本研究共涉及13个内表型疾病模块,由淀粉样变性、tau蛋白和AD中的三个经过实验验证的(种子)基因集以及来自AD基因小鼠模型中生成的蛋白质组学数据的十个差异表达的蛋白质集构建而成。随后使用网络邻近测量法筛选FDA批准的药物。桑基图(Sankey diagram)展示了66种高置信度候选药物的全局视图。网络邻近分析测量内表型疾病模块(蛋白质)和人类相互作用组中的药物靶点之间的相互作用。药物显示具有已知抗AD临床试验状态、体内动物模型以及跨血脑屏障(BBB)特性数据的药物。对于每种药物,通过网络接近度给出了Z分数。基于域界专业性(Subject matter expertise)标准的优先排序使得西地那非成为最佳候选者,与八个内表型疾病模块具有显着的近距离网络距离。
作者将Z值小于-1.5的100种药物进行排名。在排除营养药物、金属药物(铜和锌)和放射性配体诊断剂后,确定了66种候选药物。其中,影响心血管系统的药物(n= 14)的预测药物数量最多,其次是神经系统治疗药物(n= 11)、抗肿瘤和免疫调节剂(n= 9)以及消化道和代谢药物(n= 7)。早前的研究即表明,减少心血管疾病的治疗药物可能会降低AD的患病率。事实上,FDA批准的14种心血管药物中,目前有9种药物正在进行AD的临床前或临床试验。在丹曲林、去铁胺、兰索拉唑和西地那非中排除了兰索拉唑,因为其与AD风险增加有关。此外,未选择丹曲林和去铁胺是因为它们是不常用的药物,患者数据量不足以进行基于人群的验证。因此,FDA批准的治疗勃起功能障碍的药物西地那非被该研究认为是最佳候选药物。事实上许多研究均已证明血管性痴呆通常与AD一起发生,是与年龄相关的认知障碍的主要原因之一,西地那非可显着改善血管性痴呆大鼠模型的认知和记忆。
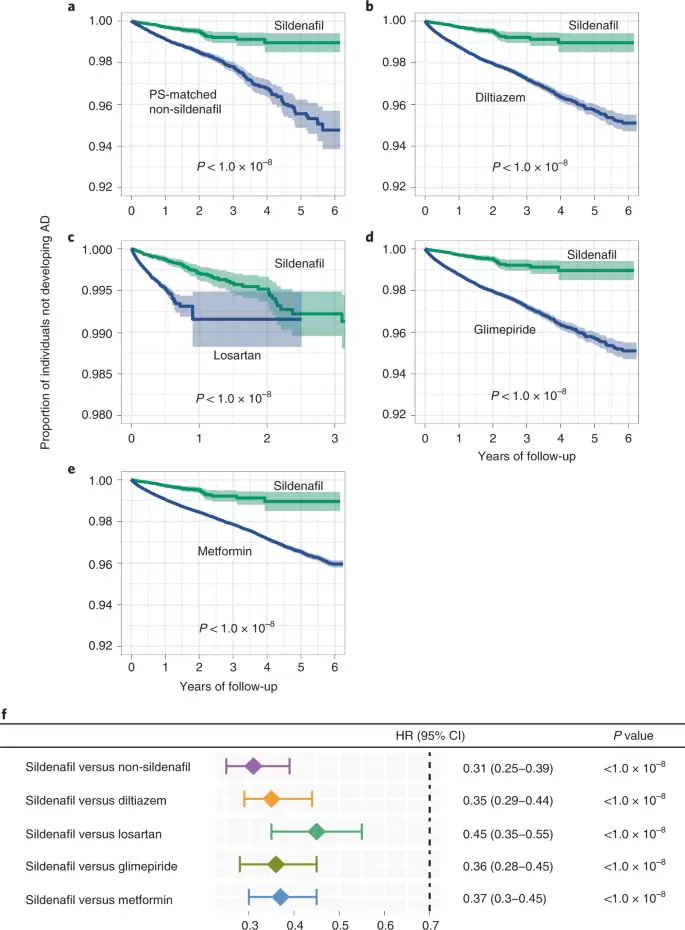
作者进一步通过分析723万美国商业保险个人和Medicare Advantage Plan受益人来评估西地那非使用者与AD结果的关系。包括三种基于药物队列的观察性研究:(1)西地那非使用者与非使用者,(2)西地那非与地尔硫卓或格列美脲相比,(3)西地那非与氯沙坦或二甲双胍相比。作者发现西地那非可显著降低69%的AD患病风险。与地尔硫卓相比,使用西地那非的AD风险降低65%。与氯沙坦相比,风险降低55%。与格列美脲相比风险降低64%。与二甲双胍相比风险降低63%。总之,这五个药物流行病学分析支持作者基于网络的预测西地那非在降低AD风险方面的潜在效用的研究结果。
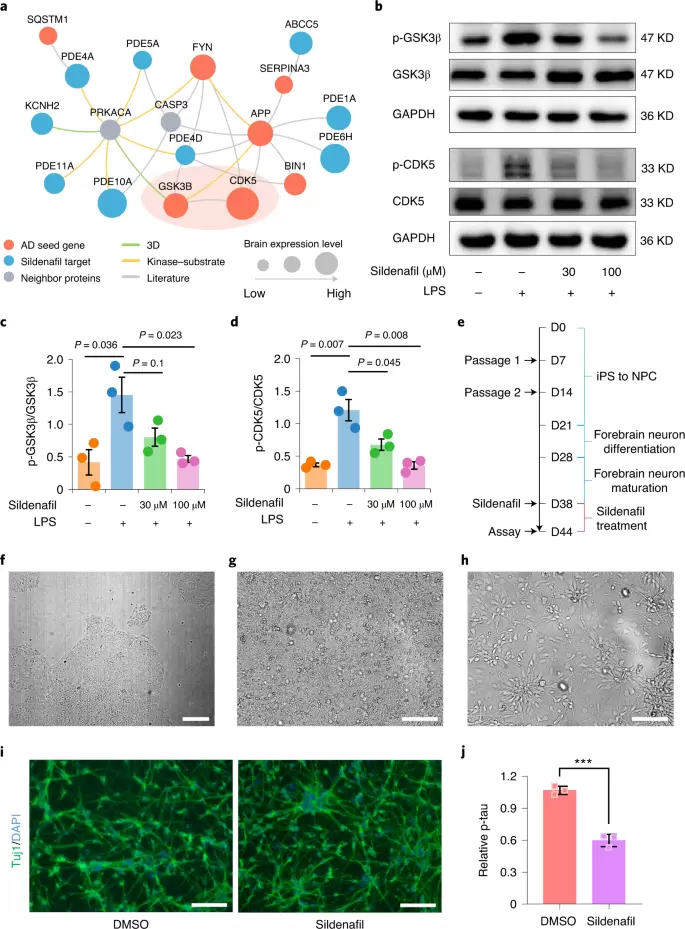
机制方面,作者做了如下探讨:首先组学数据表明GSK3β、CDK5和FYN在人脑组织中高度表达且与西地那非靶标的网络距离更近。有研究表明GSK3β和CDK5在AD发病进程和小胶质细胞介导的神经炎症中起着至关重要的作用。作者发现使用西地那非显著降低了磷酸化的GSK3β和CDK5。另外使用iPS来源的神经元细胞亦发现,西地那非可促进神经突触生长、抑制tau蛋白磷酸化。
综上,克利夫兰诊所主导的该项研究发现西地那非,一种FDA批准的治疗勃起功能障碍(伟哥)和肺动脉高压(Ravatio)的疗法,是一种有助于预防和治疗阿尔茨海默病的潜在疗法。
参考文献:
Fang,J., Zhang, P., Zhou, Y. etal. Endophenotype-basedin silico network medicine discovery combined with insurance recorddata mining identifies sildenafil as a candidate drug for Alzheimer’sdisease. NatAging (2021).https://doi.org/10.1038/s43587-021-00138-z


 我的购物车
我的购物车